Significado de átomo | Sinónimos y oraciones con ejemplos de uso de átomo
Significado de «átomo»
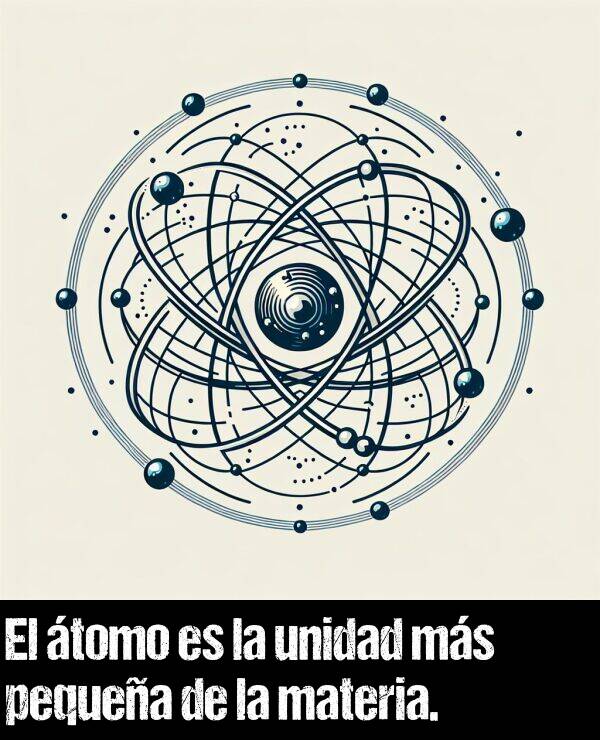
Átomo es la unidad más pequeña de un elemento químico, conservando sus propiedades.
Conformado por un núcleo de protones y neutrones, rodeado de electrones.
Se combinan para crear moléculas.
Son partículas diminutas e indivisibles, esenciales para comprender la estructura de la materia.
En sentido figurado, se usa para describir algo muy pequeño o insignificante en comparación con algo mayor.
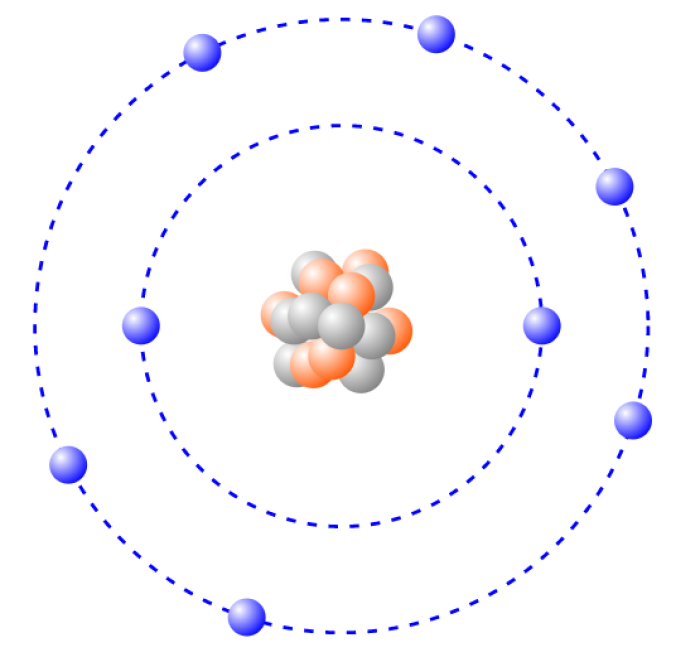
Tabla de contenido
Definición de átomo
Segundo diccionario:
átomo
Conformado por un núcleo de protones y neutrones, rodeado de electrones.
Se combinan para crear moléculas.
Son partículas diminutas e indivisibles, esenciales para comprender la estructura de la materia.
En sentido figurado, se usa para describir algo muy pequeño o insignificante en comparación con algo mayor.

- Definición de átomo
- Etimología de átomo
- Sinónimos de átomo
- Oraciones de ejemplos con "átomo"
- Análisis de "átomo" como palabra
- Palabras cercanas a "átomo"
- ¿Dudas o consultas?
Definición de átomo
- m. Quím. Elemento primario de la composición química de los cuerpos.
En química, un átomo es la unidad más pequeña de un elemento químico que mantiene las propiedades químicas de ese elemento.
Está compuesto por un núcleo central formado por protones y neutrones, rodeado por electrones en órbita. Los átomos se combinan entre sí para formar moléculas y compuestos químicos.
Ejemplos de uso: "El oxígeno es un átomo fundamental en la composición del agua, ya que cada molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno." - Partícula material microscópica.
Esta acepción se refiere a la naturaleza diminuta de los átomos, que son partículas extremadamente pequeñas e indivisibles según la teoría atómica. A pesar de su tamaño microscópico, los átomos son los constituyentes básicos de la materia y son fundamentales para entender la estructura y comportamiento de los elementos químicos. - fig. Cosa sumamente pequeña.
En un sentido figurado, "átomo" se utiliza para referirse a algo extremadamente pequeño o insignificante en comparación con algo más grande o complejo. Se emplea esta metáfora para resaltar la pequeñez o la falta de importancia relativa de algo en un contexto más amplio.
Ejemplo de uso: "En el vasto universo, cada ser humano es solo un átomo en comparación con la inmensidad del cosmos"
Segundo diccionario:
átomo
- m. La partícula más pequeña de un elemento que puede tomar parte en una reacción química. El átomo consta de un núcleo pequeño en que se halla la totalidad de la masa atómica y con una carga eléctrica positiva igual al número atómico, rodeado a una distancia relativamente grande de electrones, cargados de electricidad negativa.
- m. Cosa muy pequeña.
- Partícula material de pequeñez extremada.
- En un átomo, expr. fig. y fam. En la cosa más mínima o pequeña.
2º artículo- Así se denomina la partícula o unidad material más pequeña capaz de entrar en combinación con otra u otras análogas para formar un compuesto químico. La Física y la Química modernas postulan que toda la materia está constituida por átomos o combinaciones de éstos en forma de moléculas. Las fuerzas que mantienen unidos a los átomos en la molécula son primordialmente de naturaleza eléctrica (ver: Molécula y teoría molecular, Enlaces químicos).
Hasta 1900 se venía creyendo que el átomo era indivisible. El descubrimiento de la Radiactividad y del Electrón y el estudio de las descargas eléctricas en el seno de los gases han obligado a revisar a fondo este concepto de la indivisibilidad del átomo, que hoy se limita al aspecto químico, entendiéndose que los átomos representan el estado de máxima división de la materia asequible por procedimientos químicos.
Los átomos sirven como los bloques de construcción de toda la materia con la que entramos en contacto diariamente, sólidos, líquidos y gases; materia compuesta por una sola o varias combinaciones de elementos químicos; materia que puede sufrir cambios químicos espontáneos; materia que los químicos pueden, a través de reacciones químicas, manipular para producir todos los productos sintéticos que los humanos utilizan.
Radiactividad
El descubrimiento de la radiactividad en 1896 se atribuye a A. H. Becquerel, quien observó que las placas fotográficas se velaban cuando estaban situadas en la proximidad de muestras de pechblenda. Algo más tarde Marie Curie logró separar de dicho mineral una sal de radio y Ernest Rutherford, que trabajaba por aquel tiempo en la Universidad McGill de Montreal, encontró que las substancias radiactivas emiten espontáneamente partículas con carga eléctrica. El electrón fue descubierto por J. J. Thomson en 1896. Todos estos resultados experimentales pusieron en evidencia, de manera concluyente, que el átomo es una entidad estructurada, es decir, compuesta de partes.
Introducción
Sería una pena ser un átomo en un universo sin físicos, y los físicos están hechos de átomos. Un físico es la forma que tiene un átomo de saber sobre los átomos.
-George Wald (1906-1997), Premio Nobel de Fisiología/Medicina, 1967
La antigua idea griega (siglo V a.C.) de que toda la materia del universo consistía en diminutas entidades indivisibles no tenía ningún apoyo empírico en esa época. Mucho más tarde los polimatólogos ingleses, Robert Boyle (fechas) e Isaac Newton (1643-1727) defendieron la idea y añadieron al argumento como "corpuscularismo".
La búsqueda de las entidades más fundamentales del universo ha seguido siendo una de las fuerzas motrices más importantes de la ciencia hasta el día de hoy.
Las partículas que hoy en día llevan el nombre de "átomo" fueron encontradas por primera vez por los primeros químicos que descubrieron que no podían reducirlas a una sustancia más "elemental" por métodos químicos.
El átomo moderno sirve como la partícula fundamental para la química y como la estructura estable más pequeña para la ingeniería. La energía nuclear se genera ya sea rompiendo un átomo en dos o más átomos más pequeños (fisión), o combinando dos átomos más pequeños en uno más grande (fusión).
Historia del átomo
El siglo XIX
A principios del siglo XIX, hombres como John Dalton, Joseph-Louis Gay-Lussac y Amedeo Avogadro formularon la hipótesis de que la materia está formada por partículas diminutas, átomos como le gustaba llamarlos a Dalton, o moléculas (término preferido por Avogadro y ya utilizado por Lavoisier). Sin embargo, la diferencia entre ambos conceptos no estaba clara. Uno de los principales temas de la primera conferencia internacional de química, la histórica conferencia de Karlsruhe de 1860, fue aclarar la confusión sobre la diferencia entre átomos y moléculas. Stanislao Cannizaro ofreció por primera vez en la historia de la ciencia, una definición muy clara de los átomos como se distinguen de las moléculas. Para él, el átomo era la menor cantidad de cada elemento que entra como un todo en las moléculas que lo contienen. Sus declaraciones representaron una contribución muy notable a la aclaración de las cuestiones debatidas en aquel momento sobre las relaciones entre los átomos y las moléculas en los compuestos orgánicos e inorgánicos.
Albert Einstein da a las moléculas una realidad en su explicación del movimiento Browniano
Empleando la teoría cinética del calor y un enfoque matemático de los cambios de velocidad caracterizados por el movimiento aleatorio, en 1905 Albert Einstein dio un convincente relato del movimiento aleatorio microscópicamente observable de las partículas de polen suspendidas en un líquido, previamente señalado por el botánico Robert Brown, atribuyendo el movimiento a colisiones aleatorias de las partículas de polen con las moléculas del líquido en movimiento térmico.
El modelo "Plum Pudding" de J.J. Thomson
El primer modelo del átomo ampliamente aceptado fue el Modelo de J.J Thomson de una nube cargada positivamente con "corpúsculos" cargados negativamente, electrones, intercalados por todas partes. Thomson propuso y buscó configuraciones para que estas partículas tuvieran modos normales de vibración y fueran estables. Construyó su modelo utilizando sólo fuerzas electrostáticas, lo que requería que los electrones estuvieran en constante movimiento, lo que le llevó a mayores dificultades y nunca fue capaz de crear un modelo que coincidiera con los datos observados.
Modelo de Rutherford
Ernest Rutherford, uno de los estudiantes de Thomson, refutó su teoría en su ahora famoso experimento de dispersión mostrando que había un núcleo denso y cargado positivamente en el centro de cada átomo. Rutherford postuló que la estructura de un átomo se asemejaba más a un sistema solar con el núcleo en el centro y los electrones orbitando alrededor de él. Desafortunadamente, la Mecánica Clásica predice que estas órbitas serían inestables, se descompondrían en menos de un microsegundo, mientras que emitirían un espectro continuo de luz. Sin embargo, ya se sabía que cada elemento emitía un espectro único de líneas discretas. Rutherford no podía explicar por qué estas órbitas no decaían ni por qué los átomos no emitían el espectro continuo que estas decadencias habrían causado.
El modelo de Bohr del Átomo de Hidrógeno
En 1913 Niels Bohr ideó el primer modelo de mecánica cuántica de un átomo (de un electrón). Resolvió las dificultades del modelo de Rutherford haciendo la suposición no clásica de que sólo había estados de energía discretos y estacionarios permitidos para el electrón. Además, Bohr conjeturó que el momento angular de cada electrón estaba limitado a ser un número entero de veces la constante h de Planck dividido por 2PI. Dado que en el modelo de Bohr los electrones sólo pueden hacer saltos entre los estados estacionarios, las líneas espectrales atómicas se explicaron por la discreción de las diferencias de energía de los estados. La emisión de un fotón se produce cuando un electrón cae de un estado con energía E2 a un estado con menor energía E1. La frecuencia v del fotón emitido viene dada por
hv = E2 - E1
La absorción de un fotón de energía hv ocurre cuando hv "coincide" con una diferencia de energía atómica. Un átomo en un cierto estado salta a un estado de mayor energía, de tal manera que la diferencia de energía es igual a hv. Claramente, este requisito pone una estricta restricción en las frecuencias de los fotones que pueden ser absorbidos por el átomo.
La teoría de Bohr era para átomos de un solo electrón, pero conjeturó que muchos átomos de electrón tendrían una estructura similar. La extensión de su teoría a los sistemas de muchos electrones llevó una década más tarde a la mecánica matricial de Heisenberg y a la mecánica de ondas de Schrödinger.
La visión de hoy
Para la mayoría de los propósitos prácticos el modelo de Bohr ha demostrado ser una aproximación aceptable. Sin embargo, la interpretación de la mecánica cuántica es que los electrones están dispersos en varias distribuciones de probabilidad alrededor del núcleo en lugar de orbitarlo realmente.
Estructura del átomo
Los átomos están formados por un núcleo denso formado por combinaciones de los dos nucleones (protones con carga positiva y neutrones con carga cero) y rodeados por una "nube" de electrones mucho más grande. La gran mayoría del volumen de un átomo es espacio vacío. El número de protones contenidos en el núcleo determina el número atómico y, a su vez, el elemento como se clasifica. El número de neutrones especifica además el número de isótopos de ese elemento. El número de electrones que rodean el núcleo se supone típicamente que es igual al número de protones para mantener todo el átomo eléctricamente neutro. Los átomos que no son neutrales se denominan iones, se designan por su carga en unidades de carga elemental, que es igual al negativo del número de electrones sobrantes presentes alrededor del átomo. Así, un átomo con un electrón extra está cargado -1, y uno que falta está cargado +1.
Fuerzas en el átomo
El núcleo del átomo contiene una alta concentración de partículas cargadas positivamente sin contrarrestar las partículas cargadas negativamente para mantenerlo estable. Para explicar la existencia del núcleo, los científicos introdujeron las dos fuerzas nucleares, la fuerza fuerte y la fuerza débil. Ahora entendemos que el núcleo se mantiene unido por la fuerza fuerte residual a pesar de su significativa carga positiva. Los electrones que rodean el átomo son atraídos electroestáticamente al núcleo debido a su carga negativa.
Núcleos Estados Cuánticos
El núcleo de un átomo en sí mismo también tiene un comportamiento parecido a la cáscara no muy diferente a las cáscaras de los electrones. Esto lleva a algunos estados extra estables y semi-estables cuando el número de protones o neutrones en el núcleo es igual a los "números mágicos" 20, 28, 50, 82 y 126 que se cree que corresponden a las conchas completas. Los núcleos estables caen sobre una "línea" de estabilidad que comienza muy cerca de números iguales de protones y neutrones y se mueve hacia el favorecimiento de los neutrones para los núcleos más pesados. Esto se debe a que la repulsión electrostática de dos protones cae en magnitud mucho más lentamente que la fuerza fuerte residual. De cualquier manera los nucleones prefieren fuertemente unirse en números pares.
Decadencia
La mayoría de las combinaciones de nucleones son intrínsecamente inestables y sufren una serie de desintegraciones radiactivas para formar núcleos más estables. En todos los decaimientos comunes se emite una partícula desde el núcleo para compensar cierta inestabilidad en el átomo.
- La desintegración alfa se produce con mayor frecuencia en los átomos que son simplemente demasiado grandes, los átomos son de tamaño limitado porque la fuerza fuerte residual que los mantiene unidos sólo actúa en distancias muy pequeñas, de modo que la tasa de repulsión electrostática crece más rápido que la tasa de atracción fuerte a medida que el núcleo crece. La descomposición Alfa emite una partícula Alfa .
- El decaimiento Beta+ ocurre en átomos que son pesados en protones. En este decaimiento un protón se descompone en un neutrón y emite tanto un positrón como un neutrino. El único emisor natural de Beta+ es 40K.
- La desintegración de los beta ocurre en los átomos que son pesados en neutrones. En este decaimiento un neutrón se descompone en un protón y emite tanto un electrón como un neutrino. Un solo protón puede decaer en beta.
- El decaimiento gamma ocurre en los átomos donde el núcleo está en un estado excitado. El núcleo convertirá este exceso de energía en un fotón de alta energía, típicamente llamado rayo gamma. El decaimiento gamma típicamente sigue a un decaimiento alfa o beta que deja el núcleo con exceso de energía.
- La captura de electrones ocurre cuando un protón dentro del núcleo captura un electrón y se convierte en un neutrón.
Otros artículos sobre el átomo
• Modelo Atómico: El Átomo De Rutherford: Este autor, y más tarde H. Geiger y E. Marsden, observaron que cuando las partículas alfa emitidas por las substancias radiactivas atravesaban delgadas láminas metálicas, algunas se desviaban mucho de su dirección inicial (v. Rayos alfa). En sus trabajos de los años 1911 y 1912, Rutherford demostró ... Para seguir leyendo ver: Modelo Atómico: El Átomo De Rutherford
• El Átomo De Bohr: En 1913, Niels Bohr hizo un notable intento para explicar el origen de los espectros atómicos, desarrollando su teoría del átomo de hidrógeno y de su espectro, basada en la teoría cuántica de Max Planck y en la estructura del átomo sugerida por Rutherford. Bohr postula que: 1) el electrón extranucle... Para seguir leyendo ver: El Átomo De Bohr
• Niveles De Energía Del Átomo: En los átomos que poseen más de un electrón extranuclear, el problema de las órbitas se complica extraordinariamente y la descripción del átomo mediante órbitas electrónicas se substituye por el concepto de los «niveles» o «estados energéticos». Utilizando más sutilmente la teoría cuántica y el prin... Para seguir leyendo ver: Niveles De Energía Del Átomo
• El Núcleo Del Átomo: No se prolongó por mucho tiempo el estudio del comportamiento de los electrones extranucleares sin que la atención de los investigadores se dirigiera hacia el propio núcleo. El número de cargas positivas de éste, generalmente designado por se llama Número atómico del núcleo y también del elemento al... Para seguir leyendo ver: El Núcleo Del Átomo
• Transmutación Atómica: La conversión de un elemento en otro, que tiene lugar de manera natural entre los elementos pesados radiactivos, puede lograrse artificialmente bombardeando los átomos de un elemento con partículas adecuadas, dotadas de gran velocidad, como protones, neutrones o partículas alfa, que son núcleos de h... Para seguir leyendo ver: Transmutación Atómica
• Bombardeo Con Neutrones: El empleo de los neutrones con este objeto ofrece la ventaja de que, por no poseer carga eléctrica, no son repelidos por la del núcleo sobre el cual inciden ni por la de la nube de electrones extranucleares que lo rodea. Por ejemplo, cuando el nitrógeno-14 es bombardeado con neutrones lentos, se con... Para seguir leyendo ver: Bombardeo Con Neutrones
• Fisión Nuclear (Átomo): Es un tipo completamente distinto de reacción nuclear que se descubrió en 1939 (v. Energía atómica, Historia). Cuando un núcleo de uranio-235 recibe el impacto de un neutrón lento, se rompe, dando por lo general dos fragmentos inestables y varios neutrones y emitiendo al mismo tiempo una enorme cant... Para seguir leyendo ver: Fisión Nuclear (Átomo)
• Reacción Nuclear En Cadena: El día 2 de diciembre de 1942 se logró la primera reacción nuclear en cadena, es decir, mantenida por sí misma, en la pila atómica o reactor nuclear construido por Fermi en la Universidad de Chicago. La explicación del fenómeno es la siguiente: cada fisión de un núcleo de U-235 por la acción de un n... Para seguir leyendo ver: Reacción Nuclear En Cadena
• Fusión Nuclear: La fusión de los núcleos de los elementos ligeros es también una fuente potencial de energía, porque la masa de los núcleos reaccionantes es mayor antes que después de la fusión y la masa perdida se convierte en energía. Como estas reacciones de fusión sólo pueden tener lugar a las elevadísimas temp... Para seguir leyendo ver: Fusión Nuclear
Autor: Leandro Alegsa
← atomizaratona →
Sinónimos y antónimos de átomoVer aquí todos los sinónimos de átomo
Ejemplos de oraciones con átomo (y derivados)• « Comprender la estructura de un átomo es clave en química y física. »• « La espectroscopía permite identificar un átomo por sus líneas. »Leer más ejemplos de oraciones con átomoDiccionarios relacionadosCompartir la definición, preguntar y buscarUsa la inteligencia artificial para resolver tus dudasPreguntas de los visitantes-
Experimento de J.J. Thomson: aplicaciones en la Física
Nombre: Santiago - Fecha: 16/05/2023
¡Hola! Me encantaría saber más sobre el experimento de J.J. Thomson y sus aplicaciones en la Física. ¿Podrías brindarme información detallada al respecto? Muchas gracias.
RespuestaEl experimento de Thomson es un experimento clásico en física que se llevó a cabo en 1897 por el físico británico J.J. Thomson. En este experimento, se descubrió el electrón mediante la observación de la desviación de un haz de electrones en un campo eléctrico y magnético.
Las aplicaciones de este experimento en la física son diversas, algunas de ellas son:
1. Electrónica: El descubrimiento del electrón fue un paso fundamental en el desarrollo de la electrónica moderna, como la televisión, la radio, los teléfonos móviles y muchos otros dispositivos electrónicos.
2. Medicina: El uso de la tomografía por emisión de positrones (PET, por sus siglas en inglés) en la medicina moderna se basa en el principio del experimento de Thomson.
3. Investigación de materiales: El estudio de las propiedades de los materiales se beneficia de la capacidad de los electrones para penetrar materiales y detectar su estructura interna.
4. Física de partículas: El experimento de Thomson fue un paso fundamental en la comprensión de la estructura interna de los átomos, lo que llevó al desarrollo de la física de partículas moderna.
En resumen, el experimento de Thomson ha tenido un impacto significativo en la física y ha llevado a importantes avances en campos como la electrónica, la medicina, la investigación de materiales y la física de partículas.
Sugiero leer:
Definición de experimento
Definición de física
Definición de electrón -
Aportes importantes a la ciencia de John Alexander Reina Newlands
Nombre: Martín - Fecha: 02/06/2023
¡Hola! Estoy interesado en saber más acerca de los aportes relevantes de John Alexander Reina Newlands a la ciencia. ¿Podrían proporcionarme información detallada al respecto? ¡Gracias!
RespuestaJohn Alexander Reina Newlands fue un químico inglés que realizó importantes contribuciones a la tabla periódica de los elementos químicos. En 1864, propuso una ley de octavas que establecía que los ...
Continúe leyendo la repuesta aquí: Aportes importantes a la ciencia de John Alexander Reina Newlands -
Explicación del movimiento de átomos y moléculas
Nombre: Santiago - Fecha: 15/07/2023
¡Hola! ¿Podrían brindarme más detalles sobre el movimiento de átomos y moléculas? Me interesa comprender este tema de forma más detallada. ¡Gracias!
RespuestaEl movimiento de átomos y moléculas se debe a la energía cinética que poseen. Los átomos y moléculas están en constante movimiento, vibrando, rotando y trasladándose en un espacio tridimensional. Este movimiento se produce debido a la energía térmica que poseen, ya que los átomos y moléculas absorben energía térmica del ambiente.
Cuando se aumenta la temperatura, la energía térmica aumenta y los átomos y moléculas se mueven más rápidamente. Por otro lado, cuando la temperatura disminuye, la energía térmica disminuye y los átomos y moléculas se mueven más lentamente.
En los sólidos, los átomos están unidos por enlaces fuertes y apenas se mueven de su posición de equilibrio, aunque siguen vibrando alrededor de ella. En los líquidos y gases, los átomos y moléculas se mueven libremente y se desplazan en todas las direcciones.
El movimiento de los átomos y moléculas es fundamental en la comprensión de la física y la química, ya que afecta a las propiedades de la materia y a las reacciones químicas.
Sugiero leer:
Definición de movimiento -
Entonces, ¿los átomos son lo más diminuto que existe?
Nombre: Santiago - Fecha: 26/02/2024
¡Buen día! Me surgió una duda interesante leyendo este texto: ¿Realmente los átomos son la partícula más pequeña de la existencia? ¡Me encantaría conocer más al respecto!
RespuestaLos átomos son las unidades más pequeñas de un elemento químico que conservan sus propiedades químicas.
Sin embargo, los átomos están compuestos por partículas subatómicas aún más pequeñas, como protones, neutrones y electrones.
Por lo tanto, aunque los átomos son extremadamente pequeños, no son la estructura más diminuta que existe en el universo.
Sugiero leer:
Definición de átomo
Definición de unidad
Definición de elemento
Definición de propiedad
Definición de partícula
Fuentes bibliográficas y más información de átomo:[ Más ejemplos de oraciones y usos de "átomo" ]
[ Imágenes relacionadas a "átomo" ]
[ Usos en libros de "átomo" ]Análisis de átomoUsos de átomo
Se usa o puede usarse como: sustantivo masculino, en sentido figurado¿Cómo separar en sílabas átomo?
á-to-mo
La palabra átomo tiene 3 sílabas.¿Dónde tiene acentuación átomo?
Tiene su acento gráfico (tilde) en la sílaba: á
Tipo de acentuación de átomo: Palabra esdrújula (también proparoxítona).Pronunciación de átomo
Pronunciación (AFI): [ ˈa.to.mo ]Cantidad de letras, vocales y consonantes de átomo
Palabra inversa: omotá
Número de letras: 5
Posee un total de 3 vocales: á o o
Y un total de 2 consonantes: t m¿Es aceptada "átomo" en el diccionario de la RAE?
Ver si existe en el diccionario RAE: átomo (RAE)Categorías donde se encuentra: átomo
Física y química - Sustantivos
Palabras cercanas
Abreviaturas empleadas en la definiciónA. = alemán o antes
al. = alemán o Álava
Cant. = Cantería
Electrón. = Electrónica
expr. = expresión
fam. = familiar
fig. = figurado
gr. = griego
m. = sustantivo masculino
n. = neutro o norte
priv. = privativo
V. = Ver o Verbo
Más abreviaturas...Cómo citar la definición de átomoDefiniciones-de.com (2024). Definición de átomo - Leandro Alegsa © 10/02/2024 url: https://www.definiciones-de.com/Definicion/de/atomo.php
¿Preguntas sobre el significado de esta palabra?: respondemos aquí
[ Imágenes relacionadas a "átomo" ]

Esta imagen puedes emplearla con fines didácticos en la escuela, institución educativa o proyectos web.
- Así se denomina la partícula o unidad material más pequeña capaz de entrar en combinación con otra u otras análogas para formar un compuesto químico. La Física y la Química modernas postulan que toda la materia está constituida por átomos o combinaciones de éstos en forma de moléculas. Las fuerzas que mantienen unidos a los átomos en la molécula son primordialmente de naturaleza eléctrica (ver: Molécula y teoría molecular, Enlaces químicos).
Origen de la palabra: (del latín atómus, y éste del gr. de á, priv., y cortar, dividir.)
Preguntas y comentarios
No hay ningún comentario todavía